 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4167
Nombre de messages : 4167
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Tableaux de CO2 en fonction du pH et KH, d'où ça vient?
Tableaux de CO2 en fonction du pH et KH, d'où ça vient?
Sam 16 Mar 2024 - 22:54
On trouve sur internet de nombreux tableaux avec des valeurs plus ou moins proches, mais pas toujours absolument identiques, donnant le taux de CO2 dissous dans l'eau en fonction du pH et KH, comme celui-là :
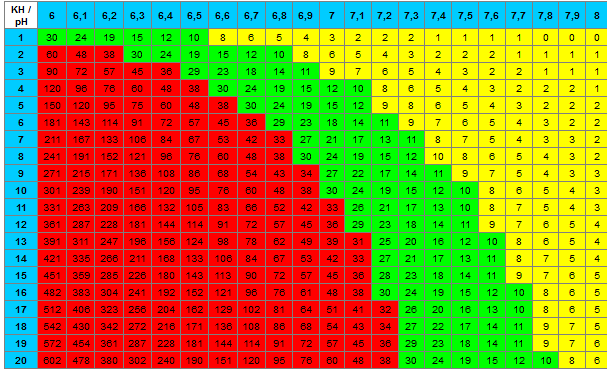
Rarement il est donné une formule; j'ai pu trouver :
%CO2 = 3.0 * d°KH * 10puissance(7.00 - pH)
(http://aquafish.free.fr/co2/co2.htm)
Mais je n'ai pas pu en retrouver la démonstration.
J'ai voulu m'y essayer comme suit.
Hypothèses essentielles :
Le pH varie toujours entre 6 et 8 dans ces tableaux je vais donc rester dans cette fourchette.
Par ailleurs, il est précisé que ce n'est pas valable en cas de présence de couples acido-basiques autres que acide carbonique / ions bicarbonates et ions bicarbonates / ions carbonates, c'est à dire par exemple en cas de présence de feuilles mortes, de filtration sur tourbe etc.
On a les deux relations d'équilibre :
. H2CO3aq + H2O <---> H3O(+) + HCO3(-) de pKa1 = 6,37
. HCO3(-) + H2O <---> H3O(+) + CO3(2-) de pKa2 = 10,32
Pour un pH dans le domaine [6.0 ; 8.0], les ions CO3(2-) sont ultra-minoritaires donc on va se contenter de la première réaction d'équilibre dans cette approche.
On a donc 10puissance(-pKa1) = 10puissance(-pH) x [HCO3(-)] / [H2CO3]
d'où [H2CO3] = 10puissance(pKa1-pH) x [HCO3(-)] formule (a)
Par définition 1d°KH est l'équivalent des ions bicarbonates/carbonates apportés par 17,9 mg/l de carbonate de Calcium (CaCO3).
Dans la gamme de pH vue précédemment, le KH mesure ici essentiellement les ions bicarbonates.
La carbonate de calcium se dissout ainsi avec l'acide carbonique CaCO3 + H2CO3 <---> Ca(2+) + 2 x HCO3(-)
donc [HCO3(-)] en mol/l = 2 x d°KH x 17,9 / Masse molaire de CaCO3, or M(CaCO3) = 100 g/mol.
donc [HCO3(-)] = 35,8 x 10puissance(-5) x d°KH formule (b)
Les formules (a) et (b) donnent donc finalement :
[H2CO3] = 35,8 x 10puissance(pKa1 - 5 - pH) = 35,8 x 10puissance(1,37 - pH) x d°KH en mol/l.
Les tableaux donnent un taux de CO2 en ppm alors que je ne peux conclure que sur une concentration de l'acide carbonique (aqueux).
Si j'utilise la masse molaire de l'acide carbonique M(H2CO3) = 62 g/mol, je ne retrouve pas les valeurs de tableau.
La dissolution lente du CO2 dans l'eau s'écrit :
CO2aq + H2O <---> H2CO3aq
donc par extension, avec M(CO2) = 44 g/mol, on a (je ne peux écrire [CO2] car CO2 est gazeux et non aqueux) :
Taux de CO2 = 44 000 x 35,8 x 10puissance(1,37 - pH) x d°KH
soit Taux de CO2 = 1.575.200 x d°KH x 10puissance(1,37 - pH) en ppm
"Esthétiquement", on peut effectivement présenter le résultat en considérant :
1.575.200 = 3 x log(5,72)
d'où Taux de CO2 = 3 x 10puissance(5,72+1,37 - pH) x d°KH
donc Taux de CO2 (ppm) = 3 x d°KH x 10puissance(7,09 - pH)
(Les valeurs dans les tableaux changent en fonction de la valeur de pKa1 prise qui n'est pas toujours la même dans la littérature.)
Je comprends mieux maintenant les limitations du tableau et comment ça s'utilise.

Rarement il est donné une formule; j'ai pu trouver :
%CO2 = 3.0 * d°KH * 10puissance(7.00 - pH)
(http://aquafish.free.fr/co2/co2.htm)
Mais je n'ai pas pu en retrouver la démonstration.
J'ai voulu m'y essayer comme suit.
Hypothèses essentielles :
Le pH varie toujours entre 6 et 8 dans ces tableaux je vais donc rester dans cette fourchette.
Par ailleurs, il est précisé que ce n'est pas valable en cas de présence de couples acido-basiques autres que acide carbonique / ions bicarbonates et ions bicarbonates / ions carbonates, c'est à dire par exemple en cas de présence de feuilles mortes, de filtration sur tourbe etc.
On a les deux relations d'équilibre :
. H2CO3aq + H2O <---> H3O(+) + HCO3(-) de pKa1 = 6,37
. HCO3(-) + H2O <---> H3O(+) + CO3(2-) de pKa2 = 10,32
Pour un pH dans le domaine [6.0 ; 8.0], les ions CO3(2-) sont ultra-minoritaires donc on va se contenter de la première réaction d'équilibre dans cette approche.
On a donc 10puissance(-pKa1) = 10puissance(-pH) x [HCO3(-)] / [H2CO3]
d'où [H2CO3] = 10puissance(pKa1-pH) x [HCO3(-)] formule (a)
Par définition 1d°KH est l'équivalent des ions bicarbonates/carbonates apportés par 17,9 mg/l de carbonate de Calcium (CaCO3).
Dans la gamme de pH vue précédemment, le KH mesure ici essentiellement les ions bicarbonates.
La carbonate de calcium se dissout ainsi avec l'acide carbonique CaCO3 + H2CO3 <---> Ca(2+) + 2 x HCO3(-)
donc [HCO3(-)] en mol/l = 2 x d°KH x 17,9 / Masse molaire de CaCO3, or M(CaCO3) = 100 g/mol.
donc [HCO3(-)] = 35,8 x 10puissance(-5) x d°KH formule (b)
Les formules (a) et (b) donnent donc finalement :
[H2CO3] = 35,8 x 10puissance(pKa1 - 5 - pH) = 35,8 x 10puissance(1,37 - pH) x d°KH en mol/l.
Les tableaux donnent un taux de CO2 en ppm alors que je ne peux conclure que sur une concentration de l'acide carbonique (aqueux).
Si j'utilise la masse molaire de l'acide carbonique M(H2CO3) = 62 g/mol, je ne retrouve pas les valeurs de tableau.
La dissolution lente du CO2 dans l'eau s'écrit :
CO2aq + H2O <---> H2CO3aq
donc par extension, avec M(CO2) = 44 g/mol, on a (je ne peux écrire [CO2] car CO2 est gazeux et non aqueux) :
Taux de CO2 = 44 000 x 35,8 x 10puissance(1,37 - pH) x d°KH
soit Taux de CO2 = 1.575.200 x d°KH x 10puissance(1,37 - pH) en ppm
"Esthétiquement", on peut effectivement présenter le résultat en considérant :
1.575.200 = 3 x log(5,72)
d'où Taux de CO2 = 3 x 10puissance(5,72+1,37 - pH) x d°KH
donc Taux de CO2 (ppm) = 3 x d°KH x 10puissance(7,09 - pH)
(Les valeurs dans les tableaux changent en fonction de la valeur de pKa1 prise qui n'est pas toujours la même dans la littérature.)
Je comprends mieux maintenant les limitations du tableau et comment ça s'utilise.
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



kiwidu21 et Anais24000 aiment ce message
 NytpawMembre : Occasionnel
NytpawMembre : Occasionnel
 Nombre de messages : 147
Nombre de messages : 147
Localisation : Saint Augustin Des Bois
Emploi : Conducteur de ligne
Date d'inscription : 22/12/2023
 Re: Tableaux de CO2 en fonction du pH et KH, d'où ça vient?
Re: Tableaux de CO2 en fonction du pH et KH, d'où ça vient?
Dim 17 Mar 2024 - 0:09
au top tes calculs
 alexv95Spécialiste plantes
alexv95Spécialiste plantes
 Nombre de messages : 3169
Nombre de messages : 3169
Localisation : Val d'Oise
Emploi : Jardinier aquatique
Date d'inscription : 10/11/2012
 Re: Tableaux de CO2 en fonction du pH et KH, d'où ça vient?
Re: Tableaux de CO2 en fonction du pH et KH, d'où ça vient?
Jeu 28 Mar 2024 - 10:04
Hello,
Merci pour cette analyse. Comme toi j'avais cherché comment ce tableau avait été construit. J'avais demandé à chat gpt qui m'avait dit que c'était issus de mesures réalisées par des aquariophiles chevronnés ^^. Autant dire que ça ne m'a pas vraiment convaincu.
Il faudrait voir si on parle bien de CO2 dissous dans ce tableau. Je suis d'accord que pour le calcul il faut repartir du H2CO3 mais comme dans l'autre post la considération qu'on a le même nombre de mol de CO2 dissous et de H2CO3 ne me semble pas plausible.
Si les calculs ont été faits jusqu'au bout peut être qu'ils en ont tenu compte...
Merci pour cette analyse. Comme toi j'avais cherché comment ce tableau avait été construit. J'avais demandé à chat gpt qui m'avait dit que c'était issus de mesures réalisées par des aquariophiles chevronnés ^^. Autant dire que ça ne m'a pas vraiment convaincu.
Il faudrait voir si on parle bien de CO2 dissous dans ce tableau. Je suis d'accord que pour le calcul il faut repartir du H2CO3 mais comme dans l'autre post la considération qu'on a le même nombre de mol de CO2 dissous et de H2CO3 ne me semble pas plausible.
Si les calculs ont été faits jusqu'au bout peut être qu'ils en ont tenu compte...
 Ha-DêAquariophile averti
Ha-DêAquariophile averti
 Nombre de messages : 4167
Nombre de messages : 4167
Age : 55
Localisation : Paris
Emploi : DG
Date d'inscription : 09/04/2012
 Re: Tableaux de CO2 en fonction du pH et KH, d'où ça vient?
Re: Tableaux de CO2 en fonction du pH et KH, d'où ça vient?
Jeu 28 Mar 2024 - 12:22
A mon avis il y a une vraie ambiguïté sur le CO2 dissous et l'acide carbonique, leur coexistence voire même leur existence est remise en question (pour certains c'est l'un ou l'autre).
Je suis resté sur des équations théoriques; sans les remettre en question, j'ai fait des hypothèses plausibles pour retrouver les résultats affichés partout.
Personnellement je ne me pose pas plus de questions, mais je me demande néanmoins en cas de coexistence, sous quelle forme les plantes assimilent préférentiellement cette source de carbone.
J'ai surtout compris que H2CO3 ne parlerait pas à grand monde donc tout le monde s'exprime faussement en CO2 (c'est comme le poids et la masse...).
Mais effectivement la concentration molaire de CO2aq et de H2CO3 n'est pas la même.
Quand on écrit CO2aq + H2O <---> H2CO3aq, c'est une réaction qui a lieu en permanence et dans les 2 sens d'ailleurs, mais sans équilibre permanent, c'est à dire qu'on ne peut écrire à tout instant [CO2aq] = [H2CO3aq] (contrairement aux équations d'équilibre avec les constantes Ka1 et Ka2).
Je suis resté sur des équations théoriques; sans les remettre en question, j'ai fait des hypothèses plausibles pour retrouver les résultats affichés partout.
Personnellement je ne me pose pas plus de questions, mais je me demande néanmoins en cas de coexistence, sous quelle forme les plantes assimilent préférentiellement cette source de carbone.
J'ai surtout compris que H2CO3 ne parlerait pas à grand monde donc tout le monde s'exprime faussement en CO2 (c'est comme le poids et la masse...).
Mais effectivement la concentration molaire de CO2aq et de H2CO3 n'est pas la même.
Quand on écrit CO2aq + H2O <---> H2CO3aq, c'est une réaction qui a lieu en permanence et dans les 2 sens d'ailleurs, mais sans équilibre permanent, c'est à dire qu'on ne peut écrire à tout instant [CO2aq] = [H2CO3aq] (contrairement aux équations d'équilibre avec les constantes Ka1 et Ka2).
_________________
Mes bacs : 240l planté/64l "Walstad"/Nano 20l/Nano 30l/Nano Reef 80l
"Walstad" = sans filtre, sans changements d'eau, substrat : terre + gravier



Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum

